Задачи практического занятия:
1. Закрепить практические знания о физических и химических свойствах, составлениях реакций присоединения и окисления на примере этилена.
2. Выполнить расчетные задачи.
Цель: Опытным путем получить этилен
Оборудование: Прибор для получения этилена, штатив с пробирками, стеклянные трубки с оттянутым концом, лучинка, фарфоровая пластинка или чашечка, чашка с песком, лабораторный штатив, горелка, спички, мензурка, свернутая спирально медная проволока,
которая должна быть вложена в газоотводную трубку. Этиловый спирт, серная кислота (конц.), раствор бромной воды и розовый раствор подкисленного перманганата калия, промытый и прокаленный речной песок.
Рекомендуемые информационные материалы:
1. Учебник О.С. Габриелян «Химия 11 класс. Базовый уровень» - М.: «Дрофа» 2024
2. Адрес публикации: https://studarium.ru/article/147
Освоены следующие компетенции:
ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их выполнение и качество.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
Количество часов: 2 часа
Критерии оценки:
- Зачет ставится в случае, если выполнено не менее 50% заданий, в освещении вопросов не содержится грубых ошибок, самостоятельно выполнена практическая работа, выполнены требования к оформлению.
- Незачет ставится, если обучающихся не справился с заданием (выполнено менее 50% задания), нераскрыто основное содержание вопросов, имеются грубые ошибки в выполнении задания, а также работа выполнена несамостоятельно.
ПРАКТИЧЕСКАЯ ЧАСТЬ
 Задание 1. Выполните практическую часть
Задание 1. Выполните практическую часть
Ход работы:
Концентрированная серная кислота обладает свойством отбирать воду у других веществ. Это свойство использовано для получения этилена.
Вода частично конденсируется на стенках пробирки и скатывается обратно в раствор.
Этилен уходит по газообразной трубке.
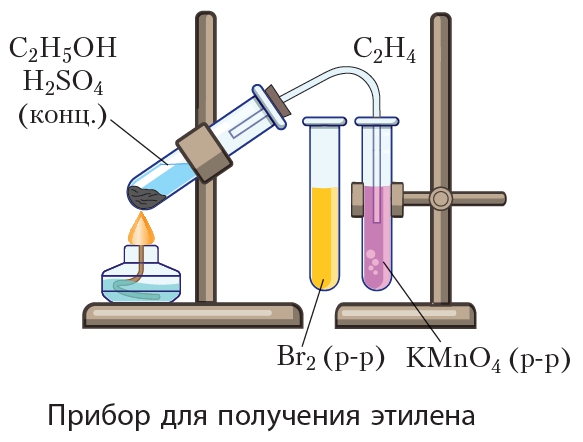
 Опыт 1. Получение этилена
Опыт 1. Получение этилена
Соберите прибор для получения этилена и проверьте его на герметичность.
Для получения этилена в пробирку поместите 1,5 мл этилового спирта, затем осторожно
прилейте 4 мл концентрированной серной кислоты и добавьте в смесь немного прокаленного песка. Закройте пробирку пробкой с газоотводной трубкой и закрепите прибор в штативе.
Сделайте вывод
 Опыт 2. Взаимодействие этилена с бромной водой
Опыт 2. Взаимодействие этилена с бромной водой
Цель: Получить этилен путём нагревания смеси этилового спирта с концентрированной серной кислотой и изучить его свойства.
Оборудование: Прибор для получения газов, водный раствор перманганата калия, раствор брома в воде (бромная вода), реакционная смесь этилового спирта и серной концентрированной кислоты (1:3), спиртовка, спички.
Ход работы:
 Опыт 1. Получение этилена
Опыт 1. Получение этилена
Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.
Осторожно, равномерно нагрейте смесь.
Выделяющийся этилен пропустим через раствор брома в воде, который называют бромной водой.
Ответьте на вопрос:
- Что происходит с бромной водой?
- Закончите уравнение реакции:
- CH2=CH2 + Br2 →
- Назовите продукты и тип реакции?
Сделайте вывод
 Опыт 3. Взаимодействие этилена с раствором перманганата калия
Опыт 3. Взаимодействие этилена с раствором перманганата калия
Выделяющийся этилен пропустим через раствор перманганата калия
Ответьте на вопрос:
- Что происходит с раствором перманганата калия?
- Закончите уравнение реакции: CH2=CH2 + КМgO4→
- Назовите продукты и тип реакции?
Сделайте вывод.
Укажите что такое качественные реакции.
 Опыт 4. Сравнение пламени этилена с пламенем предельных углеводородов (метана, пропан-бутановой смеси).
Опыт 4. Сравнение пламени этилена с пламенем предельных углеводородов (метана, пропан-бутановой смеси).
Цель: сравнить пламя горения этилен с пламенем других углеводородов (метана, пропан-бутановой смеси).
Оборудование: набор химических веществ, реактивов, химическая посуда. Прибор для получения этилена, штатив с пробирками, стеклянные трубки с оттянутым концом, лучинка, фарфоровая пластинка или чашечка, лабораторный штатив, горелка, спички, пропан-бутановая смесь.
Ход работы:
Этилен горит желтым пламенем, при внесении фарфоровой чашки она чернеет, из-за неполного сгорания этилена образуется свободный углерод — сажа черного цвета. При вдувании воздуха в пламя этилена происходит полное сгорание этилена, и пламя из желтого становится синим. Другие углеводороды горят светлым не коптящим пламенем.
- Поджечь струю этилена. Что наблюдаете?
- Поджечь смесь углеводородов. Что наблюдаете?
- Наблюдения оформить в виде вывода.
Сделайте вывод.
 Задание 2. Решите задачи с использованием плотности газов по водороду и воздуху.
Задание 2. Решите задачи с использованием плотности газов по водороду и воздуху.
Относительная плотность и газы - D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере. Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5
Разберите образец решения задачи
Углеводород содержит 81,82% углерода. Масса 1 л этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу этого углеводорода.
Решение:
1. Определим молярную массу искомого вещества:
ρ = m/V, следовательно, М (СхНу) = ρ· Vm = 1,964 г/л · 22,4 л/моль = 44
2. По формуле: n = (Wэлемента * Mr(вещества)) / Ar элемента * 100%
вычислим число атомов C, H.
Здесь Мr=M
n(C)=(81,82% · 44) / (12 · 100%) = 3
n(H)=(18,18% · 44) / (1· 100%) = 8
Получаем x:y =3 : 8, следовательно, вещество C3H8
Проверка, Mr(C3H8)= 44
Решите задачи
 Задача 1. Определите молярную массу газа, если его относительная плотность по воздуху равна 2,207.
Задача 1. Определите молярную массу газа, если его относительная плотность по воздуху равна 2,207.
 Задача 2. Относительная плотность по водороду неизвестного вещества, в котором массовая доля углерода 75%, водорода- 25%, равна 8. Найдите молекулярную формулу вещества.
Задача 2. Относительная плотность по водороду неизвестного вещества, в котором массовая доля углерода 75%, водорода- 25%, равна 8. Найдите молекулярную формулу вещества.
 Задача 3. Найдите молекулярную формулу вещества, в котором содержание углерода – 82,8%, водорода- 17,2% по массе. Относительная плотность его по водороду равна 29.
Задача 3. Найдите молекулярную формулу вещества, в котором содержание углерода – 82,8%, водорода- 17,2% по массе. Относительная плотность его по водороду равна 29.
 Задача 4. Предельный углеводород содержит 75% углерода. Его плотность по водороду-8. Найдите молекулярную формулу вещества.
Задача 4. Предельный углеводород содержит 75% углерода. Его плотность по водороду-8. Найдите молекулярную формулу вещества.
 Задача 5. Найдите молекулярную формулу углеводорода, содержание углеводорода в котором 75%, а относительная плотность по кислороду равна 0,5.
Задача 5. Найдите молекулярную формулу углеводорода, содержание углеводорода в котором 75%, а относительная плотность по кислороду равна 0,5.
 Задача 6. Найдите молекулярную формулу вещества, в котором: С- 54,4%, О- 36.4%, Н- 9,2%. Плотность паров искомого вещества по водороду 44.
Задача 6. Найдите молекулярную формулу вещества, в котором: С- 54,4%, О- 36.4%, Н- 9,2%. Плотность паров искомого вещества по водороду 44.
 Задание 3. Сделайте общий вывод по работе
Задание 3. Сделайте общий вывод по работе